Ammoniaksynthese Haber Bosch Verfahren
Okay, Leute, mal ehrlich: Habt ihr euch jemals gefragt, wo eigentlich all der Dünger herkommt, der unsere Felder so schön grün macht? Oder wie die Pflanzen überhaupt so schnell wachsen können? Die Antwort ist... Stickstoff! Und der Clou ist, wie wir den Stickstoff aus der Luft kriegen und in etwas verwandeln, das Pflanzen fressen können. Willkommen in der wundersamen Welt der Ammoniaksynthese und des Haber-Bosch-Verfahrens!
Luft anhalten und los geht's!
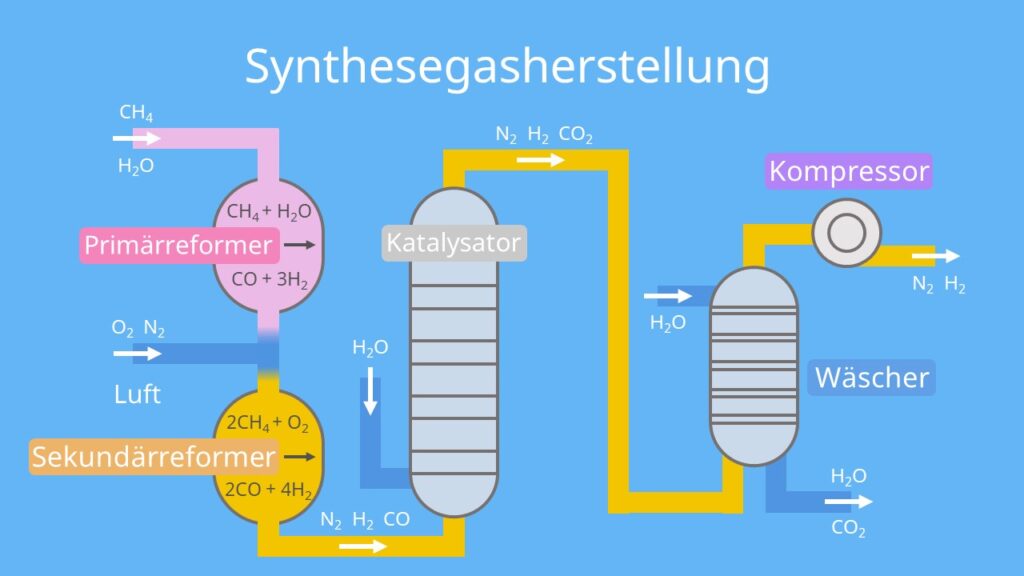
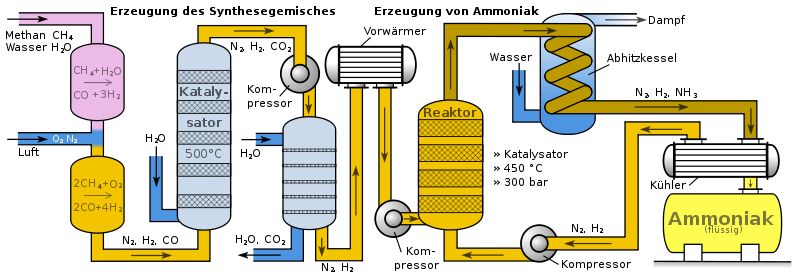
Die Luft, die wir atmen, besteht zu fast 80% aus Stickstoff. Klingt super, oder? Kostenlos und reichlich vorhanden! Das Problem ist nur: Stickstoff-Moleküle sind wie zwei beste Freunde, die sich super fest aneinanderklammern (N≡N, chemisch gesprochen, eine verdammte Dreifachbindung!). Die lassen sich nicht so leicht trennen, um dann mit anderen Stoffen zu reagieren. Stell dir vor, du willst zwei Klettverschlussbälle auseinanderziehen, die mit Industriekleber zusammengeklebt sind. Ziemlich hartnäckig, oder?
Pflanzen brauchen Stickstoff aber dringend! Er ist ein essentieller Bestandteil von Proteinen und Nukleinsäuren – also der DNA. Ohne Stickstoff gäbe es kein Wachstum, keine Ernte, keine Pommes (okay, vielleicht Pommes, aber traurige, kleine Pommes). Was also tun?
Hier kommt das Haber-Bosch-Verfahren ins Spiel
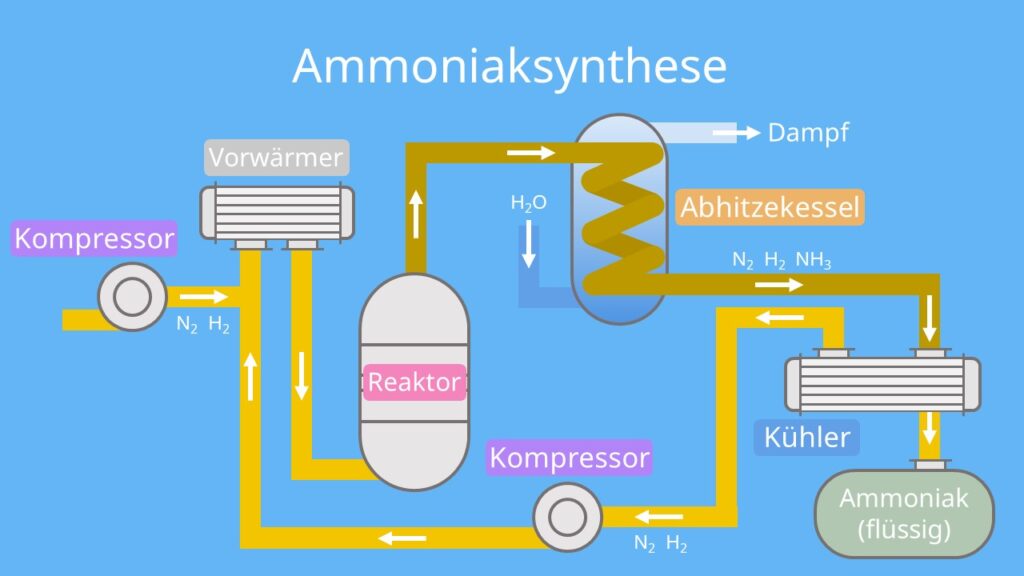
Hier kommen Fritz Haber und Carl Bosch ins Spiel – zwei deutsche Chemiker, die Anfang des 20. Jahrhunderts eine geniale Idee hatten. Sie haben herausgefunden, wie man Stickstoff aus der Luft mit Wasserstoff (H2) zu Ammoniak (NH3) verbinden kann. Das ist wie ein chemisches Speed-Dating, bei dem man die Moleküle sanft (oder auch nicht so sanft) dazu zwingt, sich zu verkuppeln.
Das Haber-Bosch-Verfahren ist im Grunde eine riesige, industrielle "Dating-App" für Atome. Stickstoff und Wasserstoff werden unter hohem Druck (ungefähr so, als würde man 200 Elefanten auf einen Kleinwagen stellen!) und hoher Temperatur (etwa 400-500°C – heißer als dein Backofen, wenn du versuchst, eine Pizza zu machen!) über einen Katalysator geleitet. Der Katalysator ist wie ein Kuppler, der die Reaktion beschleunigt und den Molekülen hilft, sich besser kennenzulernen. Meistens wird dafür Eisen verwendet.
Die chemische Gleichung sieht so aus: N2 + 3 H2 ⇌ 2 NH3. Klingt kompliziert? Ist es auch ein bisschen. Aber im Wesentlichen bedeutet es: Ein Stickstoff-Molekül und drei Wasserstoff-Moleküle werden zu zwei Ammoniak-Molekülen.
Und was bringt das jetzt?
Ammoniak ist super nützlich! Es ist die Grundlage für viele Düngemittel. Der größte Teil des erzeugten Ammoniaks wird direkt oder nach Umwandlung als Dünger in der Landwirtschaft eingesetzt. Dadurch können wir viel mehr Nahrungsmittel produzieren als früher. Und das ist ziemlich wichtig, denn wir müssen ja alle satt werden, oder?
Aber Achtung: Das Haber-Bosch-Verfahren hat auch seine Schattenseiten. Es ist extrem energieintensiv. Für die Herstellung von Ammoniak wird viel Erdgas benötigt, was wiederum zur Freisetzung von CO2 beiträgt. Außerdem kann der übermäßige Einsatz von Düngemitteln zu Umweltproblemen führen. Aber hey, niemand ist perfekt, nicht mal ein chemisches Verfahren.
Fazit: Ein Segen und eine Herausforderung
Das Haber-Bosch-Verfahren ist ohne Zweifel eine der wichtigsten Erfindungen des 20. Jahrhunderts. Es hat die Landwirtschaft revolutioniert und dazu beigetragen, die Weltbevölkerung zu ernähren. Stell dir vor, du gehst in den Supermarkt und kaufst einen saftigen Apfel – ohne das Haber-Bosch-Verfahren wäre der vielleicht nur so groß wie eine Murmel!
Allerdings müssen wir uns bewusst sein, dass diese Erfindung auch Verantwortung mit sich bringt. Wir müssen Wege finden, Ammoniak nachhaltiger zu produzieren und Düngemittel bewusster einzusetzen. Denn am Ende wollen wir ja nicht nur satt, sondern auch gesund leben – und die Umwelt für zukünftige Generationen erhalten. In diesem Sinne: Auf die Chemie und ihre manchmal verrückten, aber oft lebensrettenden Erfindungen!