Exotherme Reaktion Und Endotherme Reaktion
Hast du dich jemals gefragt, warum Eis schmilzt oder warum eine Wunderkerze so heiß wird? Die Antwort liegt in der faszinierenden Welt der chemischen Reaktionen, genauer gesagt: in exothermen und endothermen Reaktionen. Keine Panik, das klingt komplizierter als es ist! Stell dir vor, es ist wie Yin und Yang, Tag und Nacht, Anziehung und Abstoßung – zwei gegensätzliche Kräfte, die unsere Welt formen. Wir tauchen ein in diese spannende Materie, ohne den Chemie-LK-Vibe, versprochen!
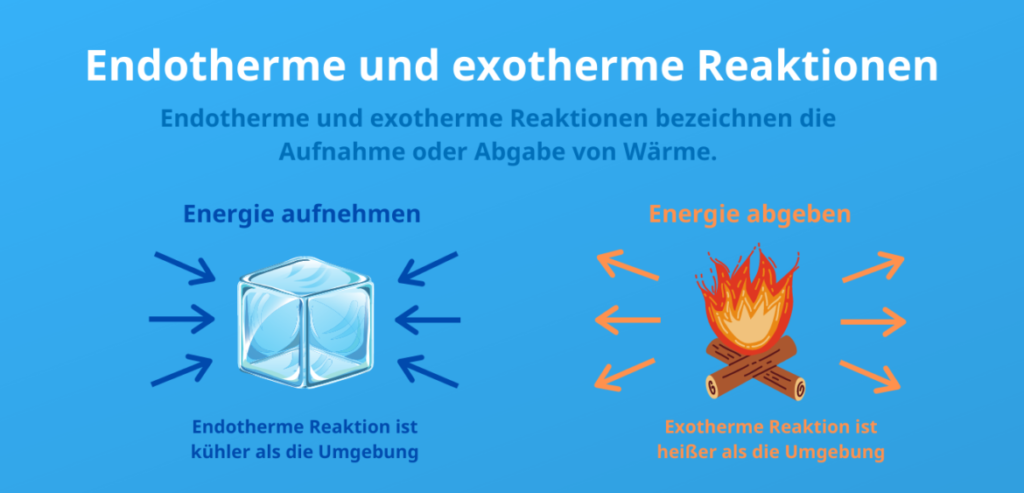
Exotherm: Energie frei Haus!
Fangen wir mit den exothermen Reaktionen an. Der Begriff kommt von "exo" (außen) und "therm" (Wärme). Merke dir: Exotherme Reaktionen sind wie der freundliche Nachbar, der dir ungefragt einen frisch gebackenen Kuchen vorbeibringt. Sie setzen Energie frei, meistens in Form von Wärme. Das bedeutet, die Umgebungstemperatur steigt. Denk an ein Lagerfeuer. Holz verbrennt (eine chemische Reaktion) und gibt Wärme ab, die uns wärmt und die Marshmallows zum Schmelzen bringt.
Praktisches Beispiel: Stell dir vor, du zündest ein Streichholz an. Die Verbrennung des Schwefels am Streichholzkopf ist eine exotherme Reaktion. Sie erzeugt Wärme und Licht – das ist das kleine Feuer, das wir zum Anzünden von Kerzen oder dem Grillen verwenden.
Fun Fact: Wusstest du, dass die meisten Verbrennungen exotherme Reaktionen sind? Egal ob es sich um Benzin im Automotor oder um die Verdauung von Nahrung in deinem Körper handelt – es wird Energie freigesetzt!
Endotherm: Energie-Hunger!
Jetzt zu den endothermen Reaktionen. Hier kommt das "endo" (innen) ins Spiel. Endotherme Reaktionen sind wie der Mitbewohner, der ständig deinen Kühlschrank plündert. Sie benötigen Energie, um abzulaufen. Diese Energie wird meistens in Form von Wärme aufgenommen, was zu einer Abkühlung der Umgebung führt. Denk an das Schmelzen von Eis. Eis braucht Wärme, um vom festen in den flüssigen Zustand überzugehen. Woher kommt die Wärme? Aus deiner Hand, aus der Luft – daher fühlt sich Eis kalt an, wenn du es berührst.
Praktisches Beispiel: Kühlpacks, die man bei Sportverletzungen verwendet, funktionieren oft nach dem Prinzip endothermer Reaktionen. Im Inneren befinden sich zwei Substanzen, die getrennt sind. Wenn man das Pack drückt, vermischen sie sich und lösen eine endotherme Reaktion aus. Die Reaktion entzieht der Umgebung Wärme, wodurch das Pack kalt wird und die Schwellung reduziert.
Kultureller Exkurs: Hast du schon mal von "Kalte Ente" gehört? Ein erfrischendes Getränk, das oft mit Weißwein und Eis zubereitet wird. Das Schmelzen des Eises ist eine endotherme Reaktion, die das Getränk kühlt und somit noch angenehmer macht.
Der feine Unterschied: Aktivierungsenergie
Egal ob exo- oder endotherm, jede Reaktion braucht einen kleinen Schubs – die sogenannte Aktivierungsenergie. Denk an einen Ball, der über einen Hügel gerollt werden muss, um ins Tal zu gelangen. Bei exothermen Reaktionen ist dieser Hügel relativ niedrig, bei endothermen höher. Katalysatoren, wie Enzyme in unserem Körper, helfen, diesen Hügel zu senken, damit die Reaktionen leichter ablaufen können.
Praktischer Tipp: Um die Unterschiede zu verstehen, kannst du einfache Experimente zu Hause durchführen (aber bitte immer unter Aufsicht von Erwachsenen!). Löse zum Beispiel Kochsalz in Wasser (fast neutral, leicht endotherm) und vergleiche es mit der Reaktion von Backpulver und Essig (exotherm – Vorsicht, sprudelt!). Fühle die Temperaturveränderung!
Fun Fact: Die Photosynthese, der Prozess, bei dem Pflanzen Sonnenlicht in Energie umwandeln, ist eine endotherme Reaktion. Pflanzen "essen" Licht, um zu wachsen!
Zusammenfassend: Exotherme Reaktionen geben Energie ab und erwärmen die Umgebung. Endotherme Reaktionen benötigen Energie und kühlen die Umgebung ab.
Was bedeutet das für uns im Alltag? Beobachte deine Umgebung bewusst. Wann hast du das letzte Mal eine exotherme Reaktion erlebt (beim Kochen, beim Anzünden einer Kerze)? Wann eine endotherme (beim Verdunsten von Schweiß auf deiner Haut, was dich kühlt)? Die Welt ist voller Chemie, und das Verständnis dieser grundlegenden Prinzipien hilft uns, sie besser zu verstehen und wertzuschätzen. Die kleinen Wunder der Wissenschaft sind überall um uns herum, wir müssen nur lernen, sie zu sehen!




