Kupfer 2 Sulfat Pentahydrat Molare Masse
Chemie – klingt erstmal nach komplizierten Formeln und unverständlichen Experimenten im Labor. Aber keine Sorge, wir tauchen heute in ein Thema ein, das eigentlich ziemlich cool und nützlich ist: die molare Masse von Kupfer(II)-sulfat-Pentahydrat. Warum das spannend ist? Weil es uns hilft, die Welt um uns herum besser zu verstehen und vielleicht sogar ein paar coole Projekte zu starten!
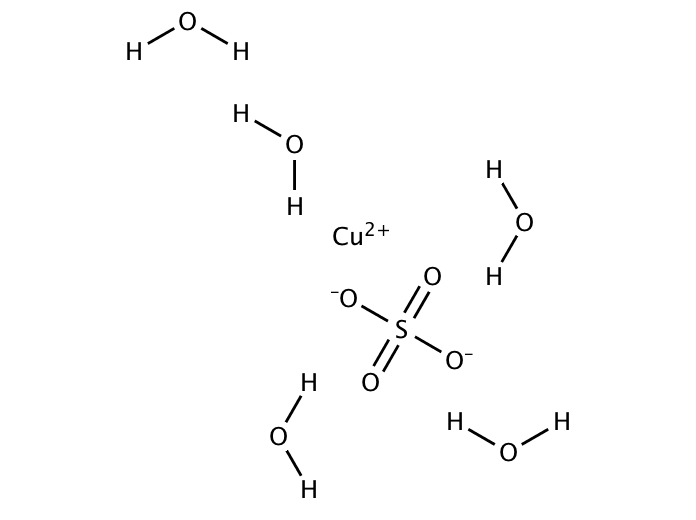
Was genau ist Kupfer(II)-sulfat-Pentahydrat? Stell dir einfach blaue Kristalle vor. Das ist es! Und was ist die molare Masse? Das ist quasi das Gewicht von einem Mol dieser Kristalle. Ein Mol ist eine bestimmte Anzahl von Teilchen (ungefähr 6,022 x 10^23, falls du es genau wissen willst), und die molare Masse gibt an, wie viel Gramm diese Menge wiegt.
Warum ist das wichtig?
- Für Anfänger: Wenn du gerade erst anfängst, dich für Chemie zu interessieren, ist das ein super Beispiel, um zu verstehen, wie Atome und Moleküle zusammenhängen und wie man ihre Masse berechnet. Es zeigt, dass alles, was wir sehen und anfassen können, aus winzigen Teilchen besteht, die ein bestimmtes Gewicht haben.
- Für Familien: Kupfer(II)-sulfat-Pentahydrat kann für spannende Experimente zu Hause verwendet werden. Denkt an Kristallzucht! Mit der molaren Masse könnt ihr genau berechnen, wie viel Kupfer(II)-sulfat ihr für eine bestimmte Menge Wasser benötigt, um die besten Kristalle zu züchten.
- Für Hobbyisten (z.B. Gärtner): Kupfer(II)-sulfat-Pentahydrat wird manchmal als Fungizid in der Landwirtschaft und im Gartenbau eingesetzt. Mit der Kenntnis der molaren Masse könnt ihr die richtige Konzentration für eure Pflanzen berechnen und sicherstellen, dass ihr sie nicht überdosiert.
Wie berechnet man die molare Masse?
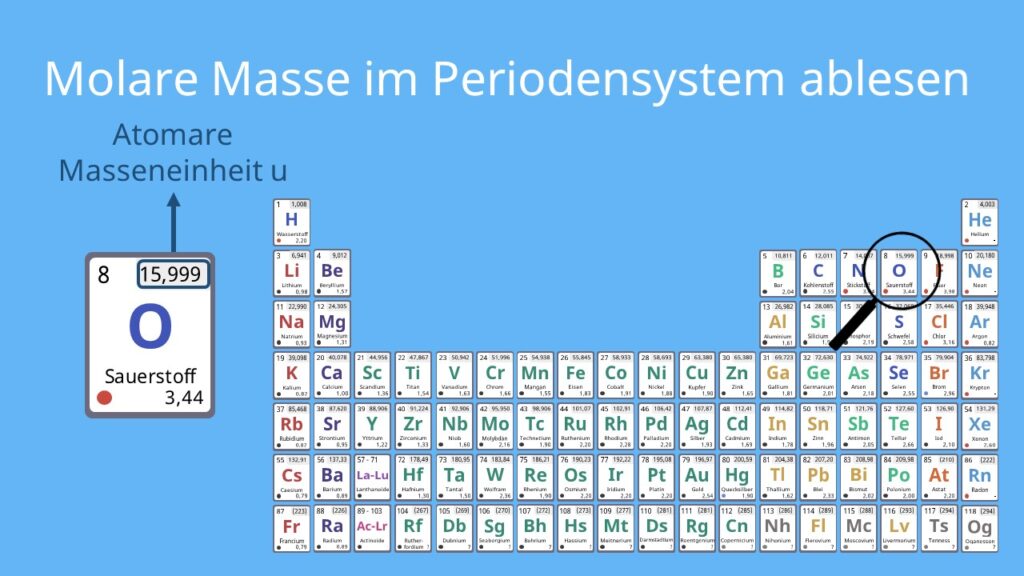
Keine Panik, das ist gar nicht so schwer! Die Formel für Kupfer(II)-sulfat-Pentahydrat ist CuSO₄ · 5H₂O. Das bedeutet, dass ein Molekül Kupfer(II)-sulfat an fünf Wassermoleküle gebunden ist. Um die molare Masse zu berechnen, brauchst du das Periodensystem der Elemente. Dort findest du die Atommasse jedes Elements:
- Kupfer (Cu): ca. 63,55 g/mol
- Schwefel (S): ca. 32,07 g/mol
- Sauerstoff (O): ca. 16,00 g/mol
- Wasserstoff (H): ca. 1,01 g/mol
Jetzt addierst du alles zusammen: 63,55 + 32,07 + (4 x 16,00) + (5 x (2 x 1,01 + 16,00)) = 249,69 g/mol. Also wiegen ca. 6,022 x 10^23 Moleküle Kupfer(II)-sulfat-Pentahydrat 249,69 Gramm.
Praktische Tipps für den Einstieg:
- Starte mit einfachen Kristallzucht-Experimenten. Im Internet gibt es viele Anleitungen.
- Nutze Online-Rechner für molare Massen, um deine Berechnungen zu überprüfen.
- Achte immer auf die Sicherheit, besonders wenn du mit Chemikalien hantierst. Trage Handschuhe und eine Schutzbrille.
Die molare Masse von Kupfer(II)-sulfat-Pentahydrat ist mehr als nur eine Zahl. Sie ist ein Schlüssel zum Verständnis der chemischen Welt und kann uns helfen, spannende Experimente durchzuführen und unser Wissen zu erweitern. Also, ran an die Kristalle und viel Spaß beim Entdecken!