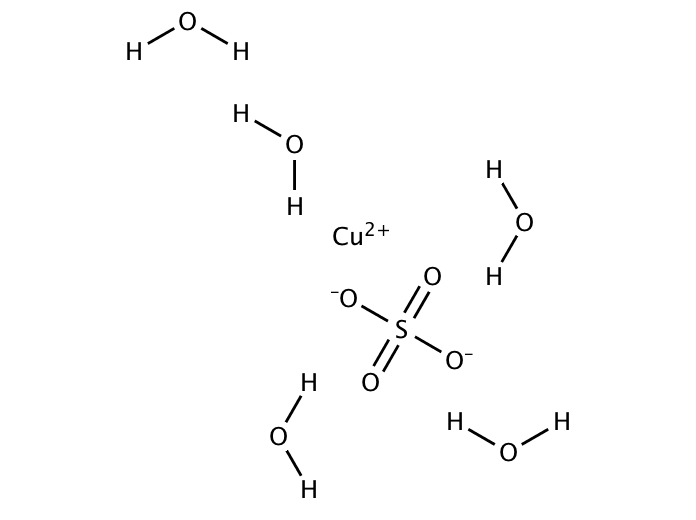
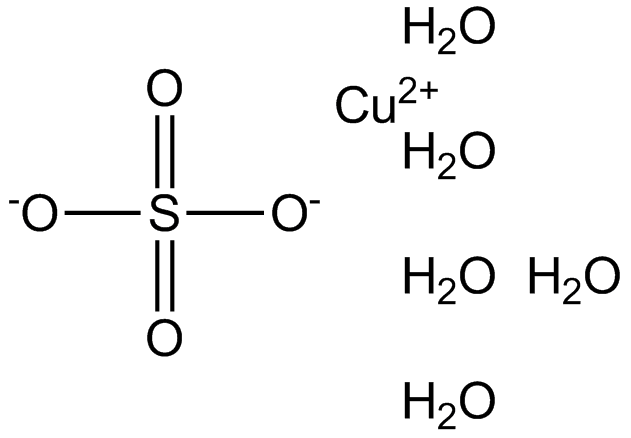
Molare Masse Kupfer 2 Sulfat Pentahydrat
Habt ihr euch jemals gefragt, wie viel ein einzelnes Molekül wiegt? Klingt vielleicht nach einer staubtrockenen Physikstunde, ist aber tatsächlich ziemlich cool! Denn das Gewicht von Molekülen, genauer gesagt die molare Masse, hilft uns, die Welt um uns herum besser zu verstehen – von der Küche bis zum Chemielabor. Heute nehmen wir uns ein ganz spezielles Molekül vor: Kupfer(II)-sulfat-Pentahydrat, auch bekannt als blauer Vitriol oder einfach CuSO₄·5H₂O. Keine Angst, es wird nicht kompliziert!
Warum gerade Kupfer(II)-sulfat-Pentahydrat? Nun, es ist nicht nur wunderschön blau (was schon mal ein Pluspunkt ist!), sondern auch super nützlich. Es wird beispielsweise als Fungizid in der Landwirtschaft eingesetzt, um Pflanzen vor Pilzbefall zu schützen. Auch im Labor findet es Verwendung, beispielsweise bei der Herstellung von Kupferoberflächen oder in chemischen Experimenten. Und wer schon mal einen Kristall gezüchtet hat, hat vielleicht sogar schon Bekanntschaft mit diesem Stoff gemacht. Aber bevor wir damit experimentieren können, müssen wir wissen, wie viel davon wir brauchen. Und da kommt die molare Masse ins Spiel!
Die molare Masse ist im Prinzip das Gewicht von einem Mol eines bestimmten Stoffes. Ein Mol ist eine bestimmte Anzahl von Teilchen (6,022 x 10²³ um genau zu sein – die Avogadro-Konstante!), und die molare Masse gibt uns das Gewicht dieser gigantischen Teilchenmenge in Gramm an. Stell dir vor, du backst einen Kuchen. Du brauchst nicht nur die Zutaten, sondern auch die richtigen Mengen. Die molare Masse hilft uns, die “richtigen Mengen” an Molekülen zu bestimmen, wenn wir etwas herstellen oder eine chemische Reaktion durchführen wollen.
Wie berechnet man nun die molare Masse von unserem blauen Freund? Ganz einfach: Wir addieren die Atommassen aller Atome, die in der chemischen Formel vorkommen. Schauen wir uns CuSO₄·5H₂O genauer an. Wir brauchen die Atommassen von Kupfer (Cu), Schwefel (S), Sauerstoff (O) und Wasserstoff (H). Diese Werte findest du in jedem Periodensystem.
Hier die ungefähren Atommassen:
- Cu: 63,5 g/mol
- S: 32,1 g/mol
- O: 16,0 g/mol
- H: 1,0 g/mol
Nun rechnen wir: CuSO₄·5H₂O besteht aus:
- 1 Kupferatom (63,5 g/mol)
- 1 Schwefelatom (32,1 g/mol)
- 4 Sauerstoffatomen (4 x 16,0 g/mol = 64,0 g/mol)
- 5 Wassermolekülen (5 x (2 x 1,0 g/mol + 1 x 16,0 g/mol) = 5 x 18,0 g/mol = 90,0 g/mol)
Addieren wir alles zusammen: 63,5 + 32,1 + 64,0 + 90,0 = 249,6 g/mol.
Das bedeutet, dass ein Mol Kupfer(II)-sulfat-Pentahydrat etwa 249,6 Gramm wiegt. Jetzt weißt du Bescheid! Die molare Masse ist ein mächtiges Werkzeug, um die Welt der Moleküle zu verstehen und zu manipulieren. Und wer weiß, vielleicht züchtest du ja bald deine eigenen wunderschönen blauen Kristalle!