Reaktion Von Magnesium Mit Sauerstoff
Okay, mal ehrlich: Haben wir nicht alle schon mal irgendwas angezündet und uns gedacht: "Wow, das brennt ja richtig gut!"? Die Reaktion von Magnesium mit Sauerstoff ist im Prinzip genau das, nur in krass.
Stell dir vor, du bist beim Grillen. Du pustest und pustest, damit die Kohle endlich mal Feuer fängt. Magnesium? Das wäre der absolute Cheat-Code für dein Barbecue. Das Zeug brennt schneller und heller als deine Hoffnungen auf perfektes Grillwetter!
Was passiert da eigentlich?
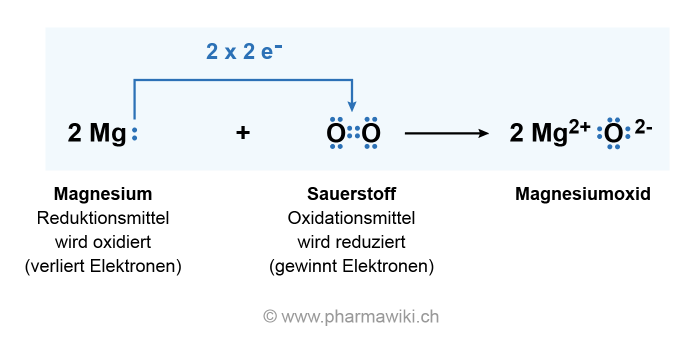
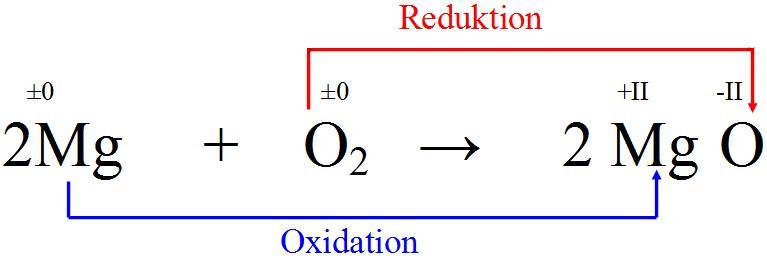
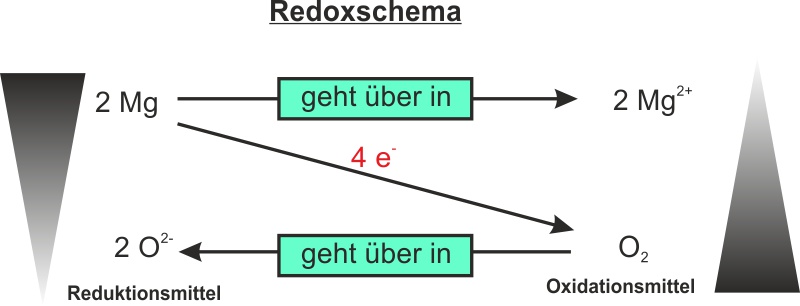
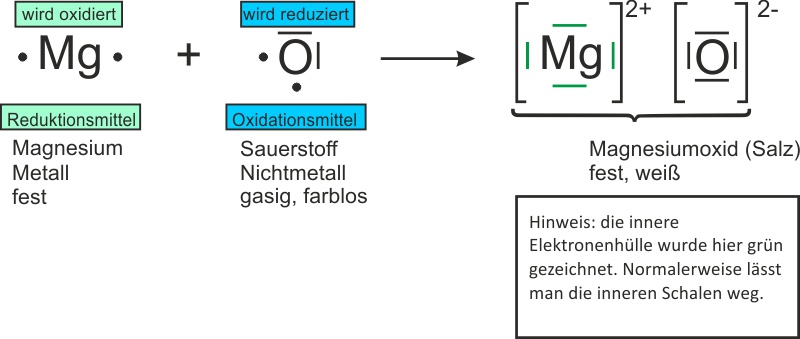
Ganz einfach: Magnesium (Mg) trifft auf Sauerstoff (O₂) und sie verlieben sich… in Form einer chemischen Reaktion. Es entsteht Magnesiumoxid (MgO). Klingt kompliziert, ist aber im Grunde nur wie wenn zwei Freunde zusammenkommen und beschließen, eine WG zu gründen. Nur dass diese WG *extrem* heiß ist und strahlend hell leuchtet!
Die Formel dazu ist: 2 Mg + O₂ → 2 MgO. Keine Panik, du brauchst das nicht auswendig zu lernen. Denk einfach dran: Magnesium und Sauerstoff machen "BÄM!" und es entsteht etwas Neues.
Warum ist das so spektakulär? Weil die Reaktion exotherm ist. Das bedeutet, dass sie Wärme freisetzt. Und zwar richtig viel Wärme. So viel, dass es nicht nur warm, sondern eben auch hell wird. Denk an ein Feuerwerk, aber ohne all die teuren Effekte drumherum. Nur pures, ungefiltertes "BUMM!"
Magnesium im Alltag? Echt jetzt?
Klar! Obwohl du wahrscheinlich nicht jeden Tag Magnesium verbrennst (was auch besser so ist…), begegnet es dir trotzdem. Denk an:
- Blitzlicht in Kameras: Früher, als Digitalkameras noch in den Kinderschuhen steckten, wurde oft Magnesium verwendet, um den Blitz zu erzeugen. Das Ergebnis waren Fotos, die aussahen, als hätte man die Person direkt in die Sonne gehalten. Heute ist das natürlich viel eleganter gelöst, aber der Ursprung ist magnesiumhaltig.
- Feuerwerkskörper: Ja, da ist es wieder! Magnesium sorgt für die hellen, weißen Blitze am Himmel. Also, das nächste Mal, wenn du "Ooooh!" und "Aaaah!" rufst, denk dran: Da ist Magnesium am Werk.
- Opferanoden: Was zum Henker ist das denn? Keine Sorge, keine blutigen Rituale. Opferanoden werden zum Schutz von Metallkonstruktionen vor Korrosion eingesetzt. Magnesium ist da super, weil es lieber korrodiert als z.B. ein Schiffsboden. Es "opfert" sich sozusagen.
Anekdote am Rande: Ich erinnere mich an einen Chemie-Unterricht, in dem unser Lehrer Magnesium verbrannt hat. Es war so hell, dass wir alle kurzzeitig Sternchen gesehen haben. Und ich meine nicht die, die man sieht, wenn man sich den Kopf stößt, sondern echte, kleine Sternchen vor den Augen! Danach wussten wir alle: Magnesium brennt nicht nur, es brennt richtig!
Also, was lernen wir daraus?
Die Reaktion von Magnesium mit Sauerstoff ist nicht nur eine trockene Chemie-Lektion, sondern ein faszinierendes Phänomen, das uns im Alltag immer wieder begegnet. Es ist wie bei einem guten Witz: Man muss ihn nicht bis ins kleinste Detail verstehen, um ihn lustig zu finden. Genauso ist es mit Magnesium: Hauptsache, es macht "BUMM!" und bringt uns zum Staunen.
Und denk dran: Wenn du das nächste Mal Magnesium anzündest (was du wahrscheinlich nicht tun solltest…), dann mach es vorsichtig und mit dem nötigen Respekt. Denn das Zeug ist heißer als der neueste Klatsch und Tratsch auf der Party!
Zusammengefasst: Magnesium + Sauerstoff = Heiß, hell, spektakulär! Und ein bisschen Chemie, die gar nicht so langweilig ist, wie sie klingt.