Redoxreaktion Magnesium Und Sauerstoff
Stell dir vor, Magnesium und Sauerstoff sitzen in einem Café. Magnesium, ein junger, aufgeregter Metall-Kerl, und Sauerstoff, eine ziemlich coole, aber auch irgendwie abhängige Gas-Dame. Was passiert? Eine Redoxreaktion, Baby! Und zwar eine, die so spektakulär ist, dass du danach wahrscheinlich ein Feuerzeug brauchst, um deine Augenbrauen wieder in Form zu bringen.
Das Drama beginnt: Magnesium will abgeben
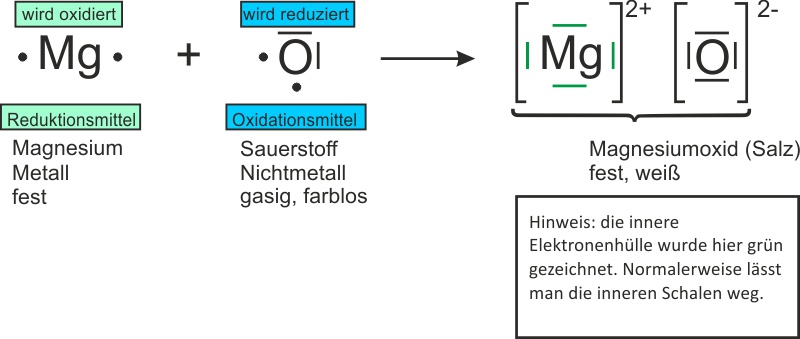
Magnesium ist, sagen wir mal, großzügig. Oder, um es wissenschaftlich korrekt zu formulieren: Magnesium ist unglaublich **elektropositiv**. Das bedeutet, er hat zwei Elektronen, die er liebend gern loswerden würde. Stell ihn dir vor, wie er da sitzt und nervös mit den Fingern trommelt, während er diese zwei kleinen Elektron-Teufelchen bei sich hat. "Muss die irgendwer haben? Bitte? Irgendwer?"
Sauerstoff, die alte Elektromagnetin, grinst nur. Sie ist nämlich elektronegativ. Das bedeutet, sie braucht dringend Elektronen, so dringend wie ich morgens meinen Kaffee. Sauerstoff ist quasi ein kosmischer Staubsauger für Elektronen. Sie schaut Magnesium an und denkt: "Bingo!"
Der Deal: Eine explosive Romanze
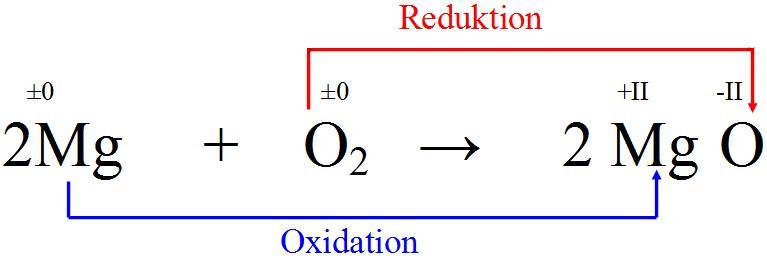
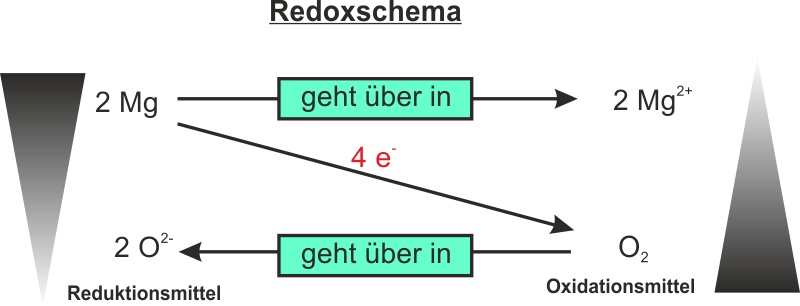
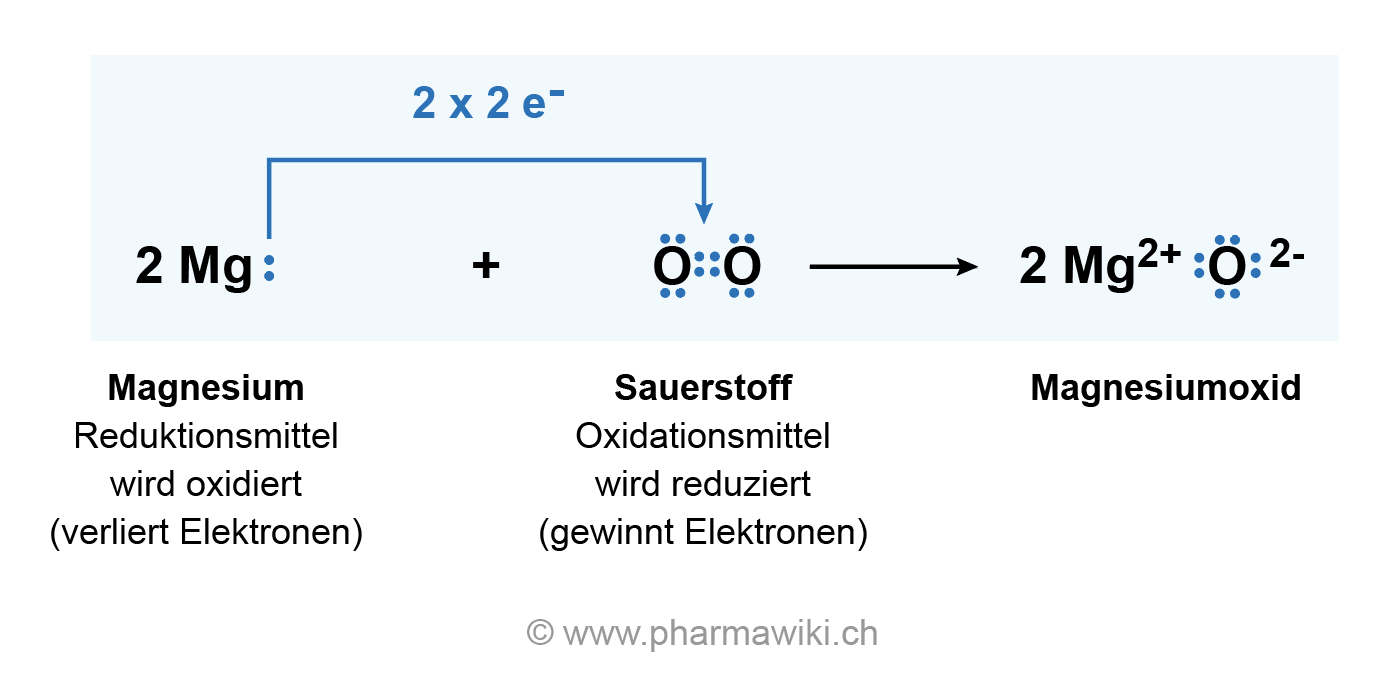
Jetzt kommt der Clou: Magnesium gibt seine zwei Elektronen an Sauerstoff ab. Das ist wie bei einem romantischen Deal, nur dass es hier keine Blumen und keine peinlichen Heiratsanträge gibt, sondern nur eine unglaublich heftige Reaktion. Magnesium wird zu einem positiv geladenen Ion (Mg2+), weil er ja zwei negative Elektronen verloren hat. Er wurde quasi "oxidiert". Stell ihn dir vor, wie er da steht, mit einem zufriedenen Grinsen im Gesicht und zwei Elektronen weniger. "Befreiung!"
Sauerstoff hingegen nimmt die Elektronen dankend an und wird zu einem negativ geladenen Ion (O2-). Er wurde "reduziert". Stell sie dir vor, wie sie die Elektronen gierig verschlingt und sich in ein stabiles, glückliches Ion verwandelt.
Die Hochzeit: Magnesiumoxid entsteht
Und was passiert, wenn sich ein positiv geladenes Magnesium-Ion und ein negativ geladenes Sauerstoff-Ion treffen? Richtig: Sie verlieben sich (elektrostatisch, versteht sich) und bilden eine feste Verbindung. Das Ergebnis ist Magnesiumoxid (MgO), ein weißes, pulverförmiges Zeug, das aussieht wie Backpulver, aber garantiert nicht schmeckt (bitte nicht probieren!).
Die ganze Sache ist exotherm. Das heißt, es wird **enorm** viel Energie freigesetzt, in Form von Licht und Wärme. Deshalb brennt Magnesium so hell, wenn man es anzündet. Es ist quasi eine Blitzhochzeit im chemischen Stil, nur viel lauter und heller.
Merke: Oxidation ist der Abgabe von Elektronen, Reduktion ist die Aufnahme von Elektronen. Und das Ganze passiert immer gleichzeitig. Es ist wie ein Tanz, bei dem der eine gibt und der andere nimmt. Ohne den einen gibt es den anderen nicht. Deswegen nennt man es auch Redoxreaktion.
Spezialeffekte: Das Magnesium-Feuerwerk
Wenn du Magnesium verbrennst, siehst du ein strahlend helles, fast blendendes Licht. Das ist kein billiger Pyro-Effekt, sondern die pure Energie, die bei der Bildung von Magnesiumoxid freigesetzt wird. Früher wurde Magnesium in Blitzlichtern für Fotografien verwendet. Stell dir vor: "Cheese!" – und dann eine Explosion von Licht, die fast das Studio in Brand setzt. Heute nehmen wir dafür LED, ist sicherer für Augenbrauen und Studio.
Fun Fact: Das Licht, das bei der Verbrennung von Magnesium entsteht, ist so hell, dass es sogar die Augen schädigen kann, wenn man zu lange direkt hineinschaut. Also bitte nicht machen! Du willst ja schließlich die nächste Redoxreaktion noch sehen können.
Anwendungen: Mehr als nur Feuerwerk
Magnesiumoxid hat übrigens viele Anwendungen. Es wird in der Medizin (als Antazidum gegen Sodbrennen – aber nicht das Zeug vom Experiment!), in der Bauindustrie (als Bestandteil von feuerfesten Materialien) und sogar in der Landwirtschaft (als Düngemittel) verwendet. Wer hätte gedacht, dass diese explosive Romanze so vielseitig sein kann?
Also, das nächste Mal, wenn du Magnesiumoxid siehst oder von einer Redoxreaktion hörst, denk an Magnesium und Sauerstoff im Café, wie sie sich in einer spektakulären, energiegeladenen Show gefunden haben. Und denk daran: Chemie ist nicht nur kompliziert und langweilig, sondern kann auch ganz schön unterhaltsam sein – wenn man sie richtig erklärt.
Und jetzt, entschuldigt mich, ich muss mir die Augenbrauen nachzeichnen. Irgendwie waren die etwas… gelichtet.