Redoxreaktionen Beispiele Mit Lösungen

Hey Leute, habt ihr euch jemals gefragt, was passiert, wenn etwas rostet oder wenn eine Batterie Strom liefert? Die Antwort ist simpler als ihr denkt: Redoxreaktionen! Klingt kompliziert, ist es aber gar nicht. Lasst uns mal eintauchen und schauen, was das eigentlich ist und warum es so eine verdammt coole Sache ist!
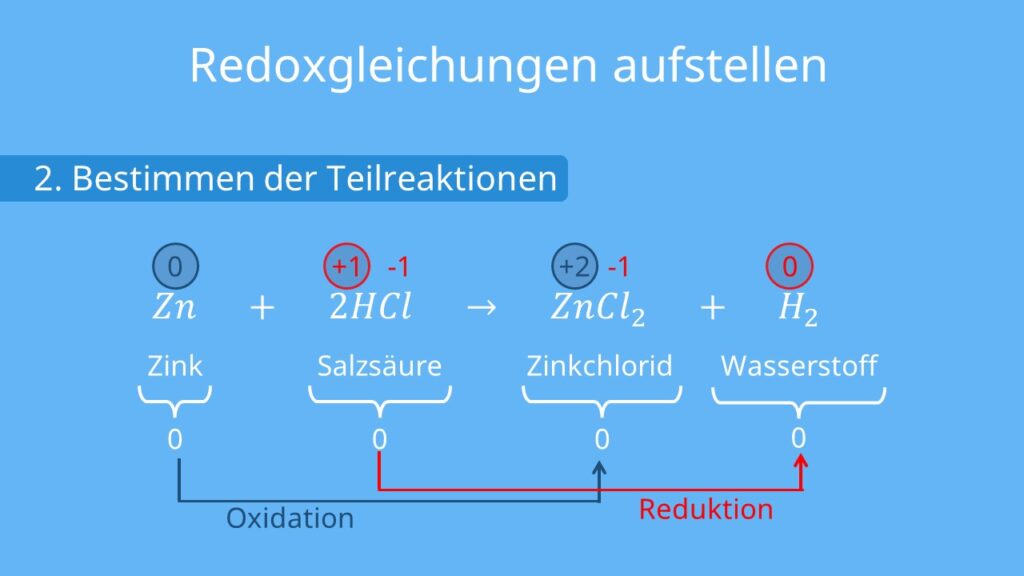
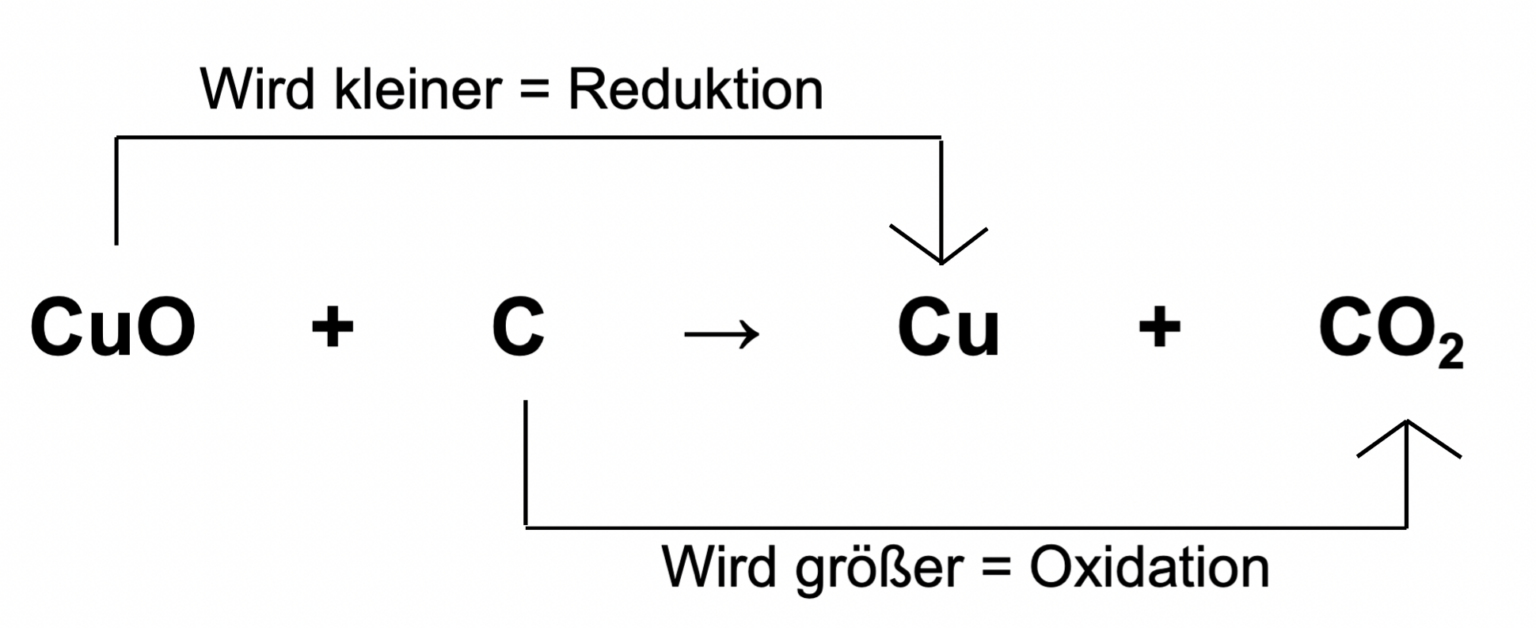
Was sind Redoxreaktionen überhaupt? Kurz gesagt, es geht um Elektronentausch. Stell dir vor, Elektronen sind kleine Fußbälle, die von einem Team zum anderen gepasst werden. Das Team, das den Ball abgibt, wird "oxidiert", und das Team, das ihn annimmt, wird "reduziert". Easy, oder?
Rosten: Der langsame Tod des Metalls (aber total interessant!)
Okay, fangen wir mit einem Klassiker an: Rost! Wer hat noch nie einen verrosteten Nagel oder ein altes Fahrrad gesehen? Rost ist nichts anderes als Eisen, das mit Sauerstoff reagiert. Das Eisen gibt Elektronen ab (wird also oxidiert), und der Sauerstoff nimmt sie auf (wird also reduziert). Das Ergebnis? Eisenoxid, auch bekannt als Rost. Ist das nicht faszinierend? Ein langsamer, chemischer Todeskampf des Metalls, direkt vor unseren Augen!
Die Reaktion sieht ungefähr so aus:
4 Fe (Eisen) + 3 O2 (Sauerstoff) → 2 Fe2O3 (Eisenoxid/Rost)
Und was ist die Lösung, um Rost zu vermeiden? Nun, das ist eine Wissenschaft für sich, aber im Wesentlichen geht es darum, das Eisen vom Sauerstoff fernzuhalten. Zum Beispiel durch Lackieren oder Verzinken. Denk mal drüber nach, jedes Mal, wenn du ein lackiertes Auto siehst, siehst du eigentlich eine Maßnahme gegen Redoxreaktionen!
Batterien: Kleine Kraftwerke in unserer Hand
Batterien sind auch geniale Beispiele für Redoxreaktionen. Hier werden chemische Reaktionen genutzt, um elektrische Energie zu erzeugen. Stell dir vor, in einer Batterie herrscht ein kleiner Krieg zwischen zwei Substanzen, die unbedingt Elektronen austauschen wollen. Einer gibt sie ab (Oxidation), der andere nimmt sie auf (Reduktion), und dieser Elektronenfluss ist das, was wir als Strom nutzen!
Nehmen wir zum Beispiel eine einfache Zink-Kohle-Batterie. Zink wird oxidiert (gibt Elektronen ab) und Kohle wird reduziert (nimmt Elektronen auf). Dieser kontrollierte Elektronentausch erzeugt den Strom, der unsere Fernbedienung oder Taschenlampe antreibt. Unglaublich, oder?
Denk mal darüber nach: Jedes Mal, wenn du dein Handy auflädst, spielst du mit Redoxreaktionen!
Photosynthese: Das Wunder der Pflanzenwelt
Jetzt wird's richtig abgefahren! Photosynthese, die Grundlage allen Lebens, ist auch eine Redoxreaktion! Pflanzen nehmen Kohlendioxid (CO2) und Wasser (H2O) auf und wandeln sie mit Hilfe von Sonnenlicht in Zucker (Glukose) und Sauerstoff (O2) um. Das Kohlendioxid wird reduziert (nimmt Elektronen auf), und das Wasser wird oxidiert (gibt Elektronen ab).
Die vereinfachte Formel lautet:
6 CO2 + 6 H2O + Lichtenergie → C6H12O6 + 6 O2
Das ist wie Magie, aber eben mit Elektronen! Pflanzen nutzen Sonnenenergie, um diese Redoxreaktion anzutreiben und uns mit Sauerstoff und Nahrung zu versorgen. Sind wir nicht alle nur Nutznießer von Redoxreaktionen?
Verbrennung: Feuer und Flamme für Redox
Und was ist mit Feuer? Auch hier spielen Redoxreaktionen eine zentrale Rolle. Beim Verbrennen von Holz oder Gas reagiert der Brennstoff mit Sauerstoff. Der Brennstoff wird oxidiert (gibt Elektronen ab), und der Sauerstoff wird reduziert (nimmt Elektronen auf). Dabei wird Energie in Form von Wärme und Licht freigesetzt. Stell dir das Lagerfeuer als eine riesige, unkontrollierte Redoxreaktion vor!
Denk mal an das nächste Mal, wenn du ein Feuer siehst: Du siehst nicht nur Flammen, sondern auch einen wilden Tanz von Elektronen!
Weitere Beispiele und Lösungen
Redoxreaktionen sind überall um uns herum. Hier sind noch ein paar Beispiele:
* Bleichen: Bleichmittel oxidieren Farbstoffe und machen sie farblos. * Silberanlaufen: Silber reagiert mit Schwefelwasserstoff in der Luft und bildet Silbersulfid (den schwarzen Belag). Das Reinigen von Silber beinhaltet die Reduktion des Silbersulfids zurück zu Silber. * Metallgewinnung: Viele Metalle werden aus ihren Erzen durch Redoxreaktionen gewonnen.Die "Lösungen" hängen immer vom jeweiligen Problem ab. Rost kann durch Lackierung verhindert werden, Silber kann mit speziellen Reinigern wieder zum Glänzen gebracht werden, und in der Industrie werden komplexe Verfahren eingesetzt, um Metalle zu gewinnen.
Fazit: Redoxreaktionen sind nicht nur irgendwelche komplizierten chemischen Prozesse. Sie sind die Grundlage für so viele Dinge, die wir im Alltag erleben – von rostigen Nägeln über leuchtende Batterien bis hin zu grünen Pflanzen. Also, das nächste Mal, wenn du eine Batterie benutzt oder ein Lagerfeuer machst, denk daran: Da tanzen Elektronen!
Habt ihr noch weitere coole Beispiele für Redoxreaktionen? Lasst es mich in den Kommentaren wissen!