Trigonal Pyramidal Molecular Geometry

Also, stell dir vor, du bist mit deinen Kumpels im Café. Wir chillen, trinken Latte Macchiato und plötzlich fragt dich jemand: "Ey, was ist eigentlich eine trigonale Pyramide – aber so, dass ich's auch verstehe?" Keine Panik, ich hab's drauf! Ich erklär's dir so locker, dass du danach jedem Molekül-Nerd die Show stiehlst!
Die Basis: Was ist überhaupt Molekülgeometrie?
Okay, bevor wir in die Pyramide eintauchen, kurz mal Grundlagen. Stell dir Moleküle nicht als flache Dinger vor, die im Chemiebuch rumliegen. Die sind dreidimensional! Und wie die Atome in diesem 3D-Raum angeordnet sind, das nennen wir Molekülgeometrie. Das ist, als würdest du Möbel in deiner Wohnung anordnen. Manche stellen das Sofa vor den Fernseher, andere ans Fenster. Atome machen das auch, aber halt mit chemischen Bindungen.
Und warum ist das wichtig? Na, die Form eines Moleküls beeinflusst ALLES! Wie es mit anderen Molekülen interagiert, ob es stinkt, schmeckt oder sogar, ob es Leben ermöglicht! Ziemlich krass, oder?
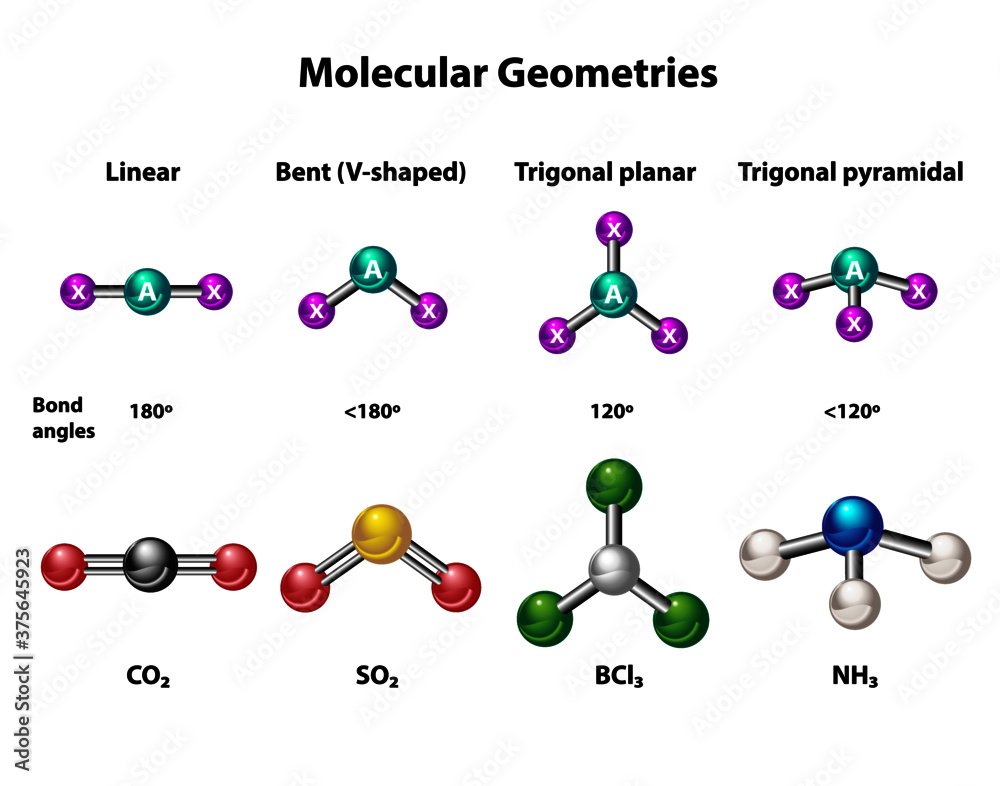
Trigonale Pyramide: Die Molekül-Version der Cheops-Pyramide
Jetzt wird's konkret. Die trigonale Pyramide ist eine bestimmte Form, die Moleküle annehmen können. Stell dir eine Pyramide vor – aber nicht die ägyptische mit quadratischer Basis, sondern eine mit einem dreieckigen Boden. Wir nennen diese dreieckige Basis "trigonal". Und weil's eine Pyramide ist, gibt's eine Spitze, die aus dem Zentrum des Dreiecks nach oben ragt.
Diese Form entsteht, wenn ein Zentralatom drei andere Atome an sich bindet und zusätzlich noch ein freies Elektronenpaar rumlungert. Denk an das freie Elektronenpaar als einen unsichtbaren, aber superstarken Magneten, der die anderen Atome abstoßt.
Hier kommt der Clou: Dieses freie Elektronenpaar braucht Platz! Mehr Platz, als wenn da ein Atom sitzen würde. Deshalb drückt es die anderen drei Atome nach unten, wodurch die Pyramide ein bisschen "eingedrückt" aussieht. Das ist, als würdest du versuchen, vier Leute in ein Auto zu quetschen, das eigentlich nur für drei gedacht ist. Irgendjemand muss leiden, und in diesem Fall leiden die Winkel zwischen den Atomen.
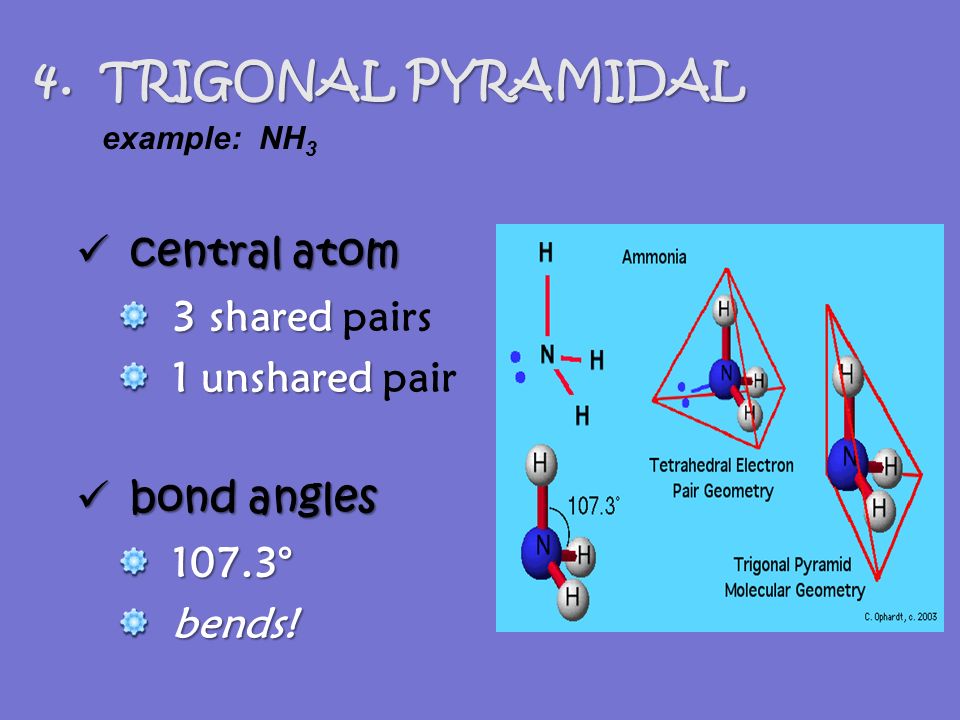
Das Paradebeispiel: Ammoniak (NH3)
Das berühmteste Beispiel für eine trigonale Pyramide ist Ammoniak (NH3). Stickstoff (N) ist das Zentralatom. Er hat drei Wasserstoffatome (H) an sich gebunden und ein freies Elektronenpaar, das wie ein bockiger Teenager auf der Couch chillt und keinen Platz machen will.
Dadurch ist der Winkel zwischen den Wasserstoffatomen nicht die idealen 120 Grad, die man bei einer perfekten trigonal planaren Geometrie erwarten würde (stell dir vor, das Stickstoffatom und die Wasserstoffatome liegen alle in einer Ebene). Nein, der Winkel ist etwas kleiner, ungefähr 107 Grad. Schuld ist das freie Elektronenpaar!
Und Ammoniak ist super wichtig! Es ist ein wichtiger Bestandteil von Düngemitteln, Reinigungsmitteln und sogar Sprengstoff. (Nicht, dass wir irgendjemanden zum Bombenbauen ermutigen wollen!).
Wichtige Fakten zum Angeben (oder für dein Chemietest)
- Zentralatom: Hat drei Bindungen und ein freies Elektronenpaar.
- Anzahl der Atome: Vier insgesamt (ein Zentralatom und drei gebundene Atome).
- Bindungswinkel: In der Regel etwas kleiner als 109,5 Grad (der Winkel einer perfekten Tetraederstruktur), weil das freie Elektronenpaar die anderen Atome abstoßt.
- Beispiele: Ammoniak (NH3), Chlorat(III)-Ion (ClO3-), Hydronium-Ion (H3O+)
Wieso ist das alles nicht flach? (Eine kleine Abschweifung)
Man könnte sich fragen: "Warum ordnen sich die Atome nicht einfach alle in einer Ebene an? Das wäre doch viel einfacher!" Tja, die Natur mag's nicht einfach. Das liegt an der Abstoßung zwischen Elektronenpaaren (VSEPR-Theorie – klingt kompliziert, ist aber eigentlich nur "Elektronen mögen keinen direkten Kontakt"). Indem sich das Zentralatom und die gebundenen Atome in einer dreidimensionalen Struktur anordnen, können sie den Abstand zwischen den Elektronenpaaren maximieren und die Abstoßung minimieren. Clever, oder?
Trigonale Pyramide im Alltag: Mehr als du denkst!
Okay, zugegeben, du wirst jetzt wahrscheinlich nicht jeden Tag über trigonale Pyramiden stolpern. Aber sie spielen eine Rolle in vielen Prozessen, die unser Leben beeinflussen. Denk an Medikamente, die an Rezeptoren in unserem Körper binden. Die Form der Medikamentenmoleküle (und damit auch ihre Molekülgeometrie) bestimmt, wie gut sie an den Rezeptor passen und wirken.
Und jetzt, wo du das alles weißt, kannst du auf der nächsten Party mit deinem neuen Wissen glänzen! Einfach so in die Runde werfen: "Wisst ihr eigentlich, dass Ammoniak eine trigonale Pyramide ist?" Garantiert Gesprächsstoff! (Oder zumindest verwirrte Blicke.)
Also, das nächste Mal, wenn du an eine Pyramide denkst, denk nicht nur an Ägypten, sondern auch an die faszinierende Welt der Moleküle! Und jetzt, lass uns noch einen Latte Macchiato bestellen. Ich hab' Durst vom ganzen Erklären!